Por Camila P. Cunha
Grandes ou microscópicos, os robôs são aliados dos médicos. A máquina não substitui o cirurgião. “Um tolo com uma ferramenta ainda é um tolo”, resume Prokar Dasgupta, urologista pioneiro da cirurgia robótica no Reino Unido. “Não há dúvida de que a qualidade do cirurgião é mais crítica do que a máquina, e o resultado da operação ainda depende de um cérebro humano.”
O termo ciborgue, cunhado por Manfred E. Clynes e Nathan S. Kline, ambos pesquisadores do Hospital Rockland State, apareceu pela primeira vez no artigo Cyborg and space publicado na revista Astronautics em 1960. O texto é um manifesto sobre a superação das limitações biológicas através de ciborgues, híbridos homem-máquina. Na época, as mentes mais brilhantes estavam voltadas para a corrida espacial. O ciborgue seria uma forma de permitir à raça humana adaptar-se a ambientes novos e extremos longe do planeta Terra, sem perder a humanidade: a capacidade de “explorar, criar, pensar e sentir de forma livre”.
No artigo, Clynes e Kline citam a bomba de Rose-Nelson (1955), como um exemplo factível de dispositivo para a construção de um ciborgue. O trabalho de Rose e Nelson é seminal ao descrever a construção de uma cápsula (bomba osmótica) capaz de liberar um fármaco de forma precisa e contínua em um órgão específico de um animal. Passados mais de 60 anos, o conceito de uma “máquina” trabalhar de forma alheia à consciência humana para a homeostase e saúde do organismo continua atual. Cientistas, químicos, bioquímicos, biólogos moleculares e físicos buscam desenvolver novos dispositivos robóticos para revolucionar a indústria farmacêutica e a prática da clínica médica e cirúrgica através da fusão das realidades física e virtual.
A revolução das máquinas na medicina começou na década de 1970 com os dispositivos endoscópicos, usados na artroscopia e na laparoscopia. Imagens ampliadas e nítidas fizeram da cirurgia um ato coletivo, em que assistentes, enfermeiros e médicos assistentes compartilham da visão privilegiada do médico principal. A partir de 1990, a técnica foi adotada como padrão em todas as áreas cirúrgicas.
Em 1998 aparecem os primeiros robôs-cirurgiões. As primeiras cirurgias foram realizadas no Hospital Broussais em Paris por Alain Carpentier e Didier Loulmet. Mais tarde, a adição da modelagem computacional, simulação e realidade virtual nas cirurgias vêm auxiliando o cirurgião no planejamento pré-operatório e na escolha do melhor procedimento, além do treinamento e ensaio dos passos mais críticos da cirurgia.
As cirurgias robóticas reduzem o trauma cirúrgico (as cirurgias são menos invasivas e demandam menor manipulação de tecidos), a internação hospitalar e a dor pós-cirurgia. Além disso, aumentam a satisfação do paciente e as taxas de recuperação, resultando na melhora da qualidade de vida de pacientes e aqueles em seu entorno, os médicos e familiares. Outra inovação é a cirurgia remota, realizada por médico e paciente situados em locais distintos. Essa vantagem pode aumentar o alcance de cirurgias feitas por poucos especialistas, muitas vezes localizados no grandes centros urbanos.
Apesar das inúmeras vantagens da adoção de cirurgias-assistidas por robôs, quem estará no controle? Robôs ou médicos? Para Timothy Lenoir, professor de história da ciência da Universidade Stanford (EUA), a questão é capciosa. “É difícil determinar quem está no controle, o robô ou o humano. Uma equipe humana claramente programa o robô, mas o robô melhora a percepção e realmente guia a mão do cirurgião, corrigindo erros devidos aos tremores das mãos (gerado por humanos)”, escreve Lenoir no artigo The virtual surgeon: New practices for an age of medialization. Lenoir também ressalta que a privacidade de nossos genomas e estilos de vida pode ser violada com o uso da robótica pelos sistemas de saúde preventivos.
Robôs-cirurgiões
Da Vinci é o robô-cirurgião mais usado no mundo, com 43 mil médicos treinados para operá-lo e mais de 5 milhões de pacientes atendidos em 66 países. O robô-cirurgião amplia as habilidades manuais e visuais do médico. Na interface homem-máquina está um console para o cirurgião, que mantém seu corpo em posição confortável e ergonômica. As mãos ficam em um joystick no formato de dedais para o controle de quatro braços robóticos (um com uma câmera e três para manipulação de instrumentos cirúrgicos) e a cabeça fica apoiada, para permitir a visualização de imagens de alta definição em 3D, captadas pela câmera.
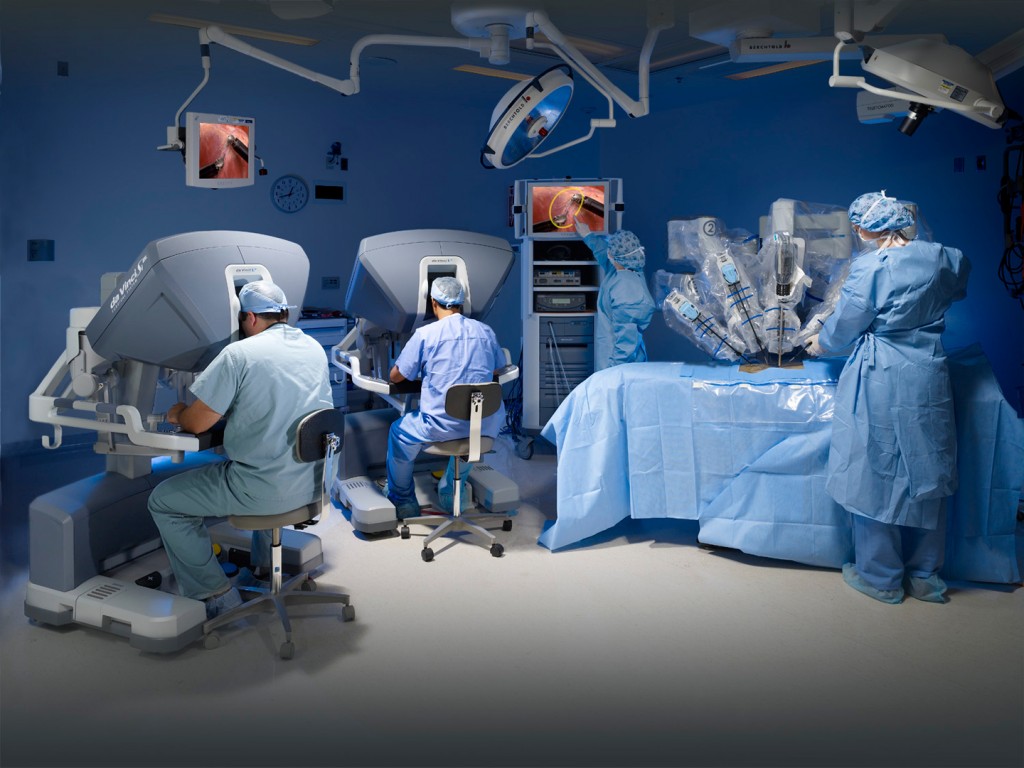 “O cirurgião pode sentar confortavelmente e isso mudou completamente a forma como realizamos a cirurgia”, diz sobre o Da Vinci o médico urologista pioneiro da cirurgia robótica no Reino Unido Prokar Dasgupta, em reportagem de Daphne Leprince-Ringuet para a revista Wired em setembro de 2018. Apesar da história de sucesso, Dasgupta acredita que a acessibilidade da tecnologia ainda é uma barreira. “Em todo o mundo, apenas 5% a 10% das operações são robóticas. O sucesso do Da Vinci deve ser temperado com o elemento realidade. Essa realidade é que [a tecnologia] não é tão disponível como deveria”, acrescenta.
“O cirurgião pode sentar confortavelmente e isso mudou completamente a forma como realizamos a cirurgia”, diz sobre o Da Vinci o médico urologista pioneiro da cirurgia robótica no Reino Unido Prokar Dasgupta, em reportagem de Daphne Leprince-Ringuet para a revista Wired em setembro de 2018. Apesar da história de sucesso, Dasgupta acredita que a acessibilidade da tecnologia ainda é uma barreira. “Em todo o mundo, apenas 5% a 10% das operações são robóticas. O sucesso do Da Vinci deve ser temperado com o elemento realidade. Essa realidade é que [a tecnologia] não é tão disponível como deveria”, acrescenta.
A primeira cirurgia robotizada realizada na América Latina ocorreu no Brasil no Hospital Sírio-Libanês em março de 2008. Hoje há 13 cirurgiões brasileiros capacitados para uso do equipamento e mais de 4,000 pacientes atendidos em pelo menos seis modalidades cirúrgicas, com destaque para as urológicas, ginecológicas e cardíacas.
A ampla adoção de sistemas robotizados no Brasil ainda é um desafio. Faltam profissionais treinados e o custo da tecnologia é limitante. Por enquanto, robôs-cirurgiões estão disponíveis apenas no serviço privado de saúde. Em 2018, o Governo do Rio de Janeiro, via Fundação de Apoio à Pesquisa do Estado do Rio de Janeiro (Faperj), anunciou o repasse de R$ 16 milhões à Universidade Estadual do Rio de Janeiro para a compra do Da Vinci pelo Hospital Universitário Pedro Ernesto, o primeiro do Sistema Único de Saúde (SUS).
“O aprendizado da cirurgia robótica é demorado e beira os limites do aceitável eticamente, já que a proficiência do operador só é alcançada após 250 a 350 intervenções. Até que se atinja esse patamar, as cirurgias são envolvidas por complicações frequentes, às vezes graves”, escreve Miguel Sprougi, médico urologista e professor da Universidade de São Paulo (USP), para o caderno Equilíbrio e Saúde do jornal Folha de S.Paulo de agosto de 2016.
“Outra questão é o elevado custo de aquisição e de manutenção desse procedimento, da ordem, respectivamente, de mais de US$ 3 milhões e de mais de US$ 300 mil anuais. Valores utópicos para oferecer a técnica a uma nação com a saúde devastada e com prioridades elementares inatingíveis para a sua população; e também mais onerosa para quem se dispõe a realizá-la sem patrocínio”, pondera Sprougi.
Com o vencimento de patentes do sistema Da Vinci, outros robôs-cirurgiões já começam a aparecer no mercado, entre eles, Preceyes para cirurgias oculares, CorPath GRX (Corindus Vascular Robotics) para cirurgias cardíacas, Monarch (Auris Health) para o diagnóstico e tratamento do câncer de pulmão, Mako (Stryker) para cirurgias de substituição de articulações no quadril e joelho e o Versius (CMR Surgical), competidor direto do Da Vinci que promete mais flexibilidade em relação à movimentação dos braços e também da máquina entre salas operatórias e economia para aquisição, manutenção e operação.
Dasgupta lembra que a máquina não substitui o cirurgião. “Um tolo com uma ferramenta ainda é um tolo”, comenta, e acrescenta, “Não há dúvida de que a qualidade do cirurgião é mais crítica do que a máquina, e o resultado da operação ainda depende de um cérebro humano. A especialização cirúrgica continua fundamental”.
Microrrobôs
A partir da década de 1990, métodos e ferramentas para o posicionamento e a movimentação de objetos microscópicos através de estruturas tipo pinça, pipeta ou cantilever (micromanipulação) permitiram o desenvolvimento dos primeiros sistemas micro-robóticos, acionados por motores ou guiados por campos físicos remotos, capazes de executar tarefas muito específicas e de se movimentarem em diferentes meios, sólidos ou líquidos.
“A biologia usa reações catalíticas de combustíveis químicos para fazer as coisas se moverem. Antes do trabalho que vários grupos, incluindo o meu, fez em micro-motores sintéticos entre 2002 e 2005, esse conceito não existia no mundo da máquina”, explica Thomas E. Mallouk, professor da Universidade Evan Pugh (EUA) e diretor associado do Center for Nanoscale Science da Universidade Estadual da Pensilvânia (EUA) em entrevista à ComCiência. “Agora, nós e muitos outros pesquisadores descobrimos que não apenas a energia química, mas também a energia elétrica, magnética e acústica podem ser usadas para impulsionar objetos e controlar o movimento na escala de nanômetros a micrômetros.”
A micromanipulação feita com células começou a partir do ano 2000, tendo como uma das primeiras aplicações práticas da tecnologia a fertilização in vitro. Com uma estrutura similar a um sugador, o óvulo é posicionado no campo visível de um microscópio, depois uma microinjeção, contendo um único espermatozóide, perfura a célula depositando-o no citoplasma. Hoje as aplicações se multiplicam, com implicações para o diagnóstico e tratamento de doenças, compreensão de patologias e desenvolvimento de novas abordagens terapêuticas.
O desafio é o desenvolvimento de microrrobôs capazes de navegar pelo organismo e liberar fármacos em órgãos ou células alvo sem serem reconhecidos pelo sistema imunológico como corpos estranhos. As tecnologias em fase experimental mais promissoras hoje se assemelham à bomba de Rose-Nelson. Entre elas estão os microrrobôs motorizados (estrutura artificial) e microrrobôs bio-híbridos nadadores (vide abaixo).
“O maior desafio [para desenvolvimento da tecnologia] é reunir as comunidades de pesquisa da medicina, física e química para conversar sobre as tecnologias e identificar aquelas com aplicações médicas mais fáceis e úteis para serem implementadas primeiro. Outro desafio importante é aprender como desenvolver robôs mais complexos em escala muito pequena (dez nanômetros), capazes de criar coletivamente inteligência, ou seja, aprender a sentir o ambiente, gerar relatórios para nós e tomar decisões coletivas simples, como fazem as revoadas de pássaros ou cardumes de peixes”, explica Mallouk.
Microrrobôs motorizados
Em 2017, engenheiros biomédicos da Universidade da Califórnia em San Diego (EUA) desenvolveram um microrrobô capaz de transportar antibiótico para tratar úlcera causada pela bactéria Helicobacter pylori em camundongo, organismo modelo usado em testes laboratoriais.
Quando no estômago, o microrrobô, feito de magnésio e quitosana, libera microbolhas que ajudam na sua propulsão para maior dispersão, enquanto a quitosana auxilia a retenção da droga na mucosa. O magnésio também ajuda no controle da acidez estomacal produzida pelo excesso de ácido gástrico, o que garante maior potência do antibiótico.
A não administração de inibidores da bomba de prótons (usados no tratamento de úlceras gastrointestinais, como omeprazol) conjuntamente ao antibiótico reduz os efeitos colaterais do uso continuado dos fármacos, como diarréia, náusea, dores de cabeça, ansiedade e até depressão.
Microrrobôs bio-híbridos
Os microrrobôs bio-híbridos combinam organismo vivos e suas habilidades únicas de motilidade e sistemas sensores com carregadores artificiais de drogas. Um exemplo que combina rastreabilidade, biodegradabilidade, eficiência na liberação de droga e citotoxicidade seletiva para células cancerosas é descrito em 2017 por cientistas da Universidade de Hong Kong (China) e das Universidades de Edimburgo e Manchester (Reino Unido).
Os cientistas criaram um microrrobô bio-híbrido feito a partir de cianobactérias (Spirula platensis) que se aglutinam formando um arranjo helicoidal induzido artificialmente no laboratório, contendo um centro oco, onde fármacos podem ser carregados até o órgão ou células de interesse. A estrutura orgânica é recoberta com nanopartículas de magnetita.
A camada magnética externa permite o controle da locomoção do microrrobô em diferentes fluidos (água, sangue, suco gástrico, urina e óleo vegetal) e dentro do organismo. Quando atinge a região desejada, a estrutura é biodegrada, liberando o fármaco nas células alvo.
Os exemplos de microrrobôs citados demonstram provas de conceito e a aplicabilidade dessa nova tecnologia para o tratamento de doenças. “As aplicações biomédicas ainda estão engatinhando. As fases dos testes clínicos para novas aplicações in vivo levam muitos anos. Mas o desenvolvimento de pequenos e grandes microrrobôs é promissor”, comenta Mallouk. “Podemos esperar muitas outras aplicações interessantes para tratamentos médicos minimamente invasivos e diagnósticos no futuro.”
Camila P. Cunha é engenheira agrônoma (Esalq/USP), doutora em genética e biologia molecular e especialista em jornalismo científico pela Unicamp. Integra o Programa Mídia Ciência da Fapesp.
Crédito imagem: Pixabay
Os artigos citados nesta reportagem podem ser lidos em: Nature communications (doi: 10.1038/s41467-017-00309-w) e Science robotics (doi: 10.1126/scirobotics.aaq1155)

